Регистрация медицинских изделий — важный и сложный процесс, который составляет неотъемлемую часть регулирования и контроля качества медицинских изделий на рынке. Для успешного прохождения этапов государственной регистрации, производители и поставщики медицинских изделий должны ориентироваться на законы и требования, определяемые ФГУП «Росздравнадзор».
Составление регистрационного досье — одно из ключевых требований для получения разрешения на ввоз и реализацию медицинских изделий на территории Российской Федерации. В процессе регистрации необходимо провести тщательное оформление документов и предоставить полный перечень информации о медицинском изделии: от его назначения и услуг, которые могут быть оказаны с его использованием, до клинического образца и анализа риска, связанного с его применением.
Определение режима регистрации происходит с учетом класса риска медицинского изделия: I, IIa, IIb или III. Для каждого класса определены особенности ведения документации и процедур, которыми необходимо руководствоваться при проведении регистрации. Кроме того, важно учесть требования к информации о медицинском изделии, предоставляемой в регистрационном досье.
Преимущества прохождения государственной регистрации медицинских изделий очевидны: это повышение доверия потребителей, осуществление контроля и обеспечение безопасности продукции на рынке. Однако проведение этой процедуры обязательное и влечет за собой определенные обязательства и ответственность для производителя.

Процесс регистрации медицинских изделий: создание регистрационного досье
Для регистрации медицинских изделий в Российской Федерации необходимо проходить процесс государственной регистрации в Федеральной службе по надзору в сфере здравоохранения (Росздравнадзор).
Создание регистрационного досье – один из важных этапов в этом процессе. Регистрационное досье представляет собой комплекс документов, подтверждающих безопасность и эффективность медицинского изделия, его соответствие требованиям законодательства и назначение.
Подача заявки и оплата
Первым этапом процесса регистрации является подача заявки на государственную регистрацию. Заявитель должен уплатить регистрационную пошлину и предоставить необходимые документы. Оплата пошлины осуществляется в соответствии с законами РФ и правилами Росздравнадзора.
Составление регистрационного досье
Составление регистрационного досье производится согласно правилам, определенным Росздравнадзором. Досье должно включать информацию о медицинском изделии, его производителе, месте изготовления, сведениях о сертификации и декларировании качества продукции. Также в досье должны содержаться результаты лабораторных и клинических испытаний, проведенных в аккредитованных лабораториях или организациях, имеющих соответствующие лицензии.
Успешное прохождение испытаний и получение удостоверения соответствия
После составления регистрационного досье медицинское изделие должно пройти испытания на соответствие требованиям безопасности и эффективности. Эти испытания проводятся в аккредитованных испытательных центрах, таких как ГЦКП «ЦИРМИ» ФГУП «ВНИИИМТ».
В случае успешного прохождения испытаний и получения положительных результатов, заявитель может получить удостоверение о соответствии. Это удостоверение является одним из ключевых документов, подтверждающих право медицинского изделия на коммерческое использование.
Удостоверение обязательно для коммерческого использования медицинского изделия на территории РФ. Без него регистрация и продажа такого изделия невозможны.
При регистрации медицинского изделия руководствуются законами РФ и правилами Росздравнадзора, а также требованиями ЕАЭС (Евразийского экономического союза). Ориентируясь на эти нормы, заявитель обязан предоставить все необходимые документы и информацию, демонстрирующую безопасность и эффективность медицинского изделия.
Регистрация медицинских изделий и создание регистрационного досье являются обязательными процедурами, которые затрагивают здоровье и безопасность людей. Поэтому все участники процесса регистрации – заявитель, испытательные центры, Росздравнадзор и другие органы – несут ответственность за правильное выполнение своих обязанностей и соблюдение всех требований.
Определение класса риска медицинских изделий
Определение класса риска медицинского изделия осуществляется на основе его назначения и потенциального воздействия на человека. Для этого производится анализ клинических данных, результатов исследований и испытаний, выполненных в соответствии с требованиями, предоставляемыми в заявлении о регистрации.
Классы риска медицинских изделий в России определяются в соответствии с государственными стандартами и правилами, в том числе согласно ГОСТ Р 51909-2002 (классы А, B, C, D), а также с учетом рисков, связанных с использованием медицинского изделия.

Класс риска медицинских изделий влияет на требования к их регистрации и оформлению регистрационного досье. Так, для изделий низкого класса риска (класс А) процесс регистрации может быть упрощенным и требовать меньшего количества документов и испытаний, в то время как для изделий высокого класса риска (класс D) процесс может быть более сложным и требовать более тщательной экспертизы.
Правильное определение класса риска медицинских изделий является важным шагом для успешной регистрации и дальнейшей продажи на рынке. Мы, компания «Медизделия 2020», работаем над оформлением регистрационных досье и обеспечиваем надежное и профессиональное сопровождение процесса регистрации медицинских изделий. Мы ориентируемся на правила и требования Росздравнадзора и ЦИРМИ, исходя из вашего предложения. Оплата за услуги осуществляется поэтапно и без задержек.
Важные аспекты определения класса риска:
- Класс риска определяется на основе клинической значимости и патенциальной опасности медицинского изделия для пациентов и здравоохранения.
- Определение класса риска осуществляется на этапе разработки и производства медицинского изделия.
- Определение класса риска является основополагающим фактором при выборе методов испытаний и анализа данных в рамках процесса регистрации.
Процесс определения классов риска:
- Определение цели использования и назначения медицинского изделия.
- Анализ клинических данных и результатов исследований, взятых из заявления о регистрации.
- Определение потенциального воздействия медицинского изделия на человека.
- Определение класса риска согласно правилам и требованиям ГОСТ-эксперта и государственной комиссии.
Определение основных требований для регистрации
Виды медицинских изделий, подлежащих госрегистрации, определяются Законом о медицинских изделиях. Процедура регистрации состоит из ряда этапов, которые выполняет компания-заявитель.
Первым этапом является определение основных требований для регистрации. Компания должна собрать необходимые документы и удостоверения:
- Заявление о проведении государственной регистрации
- Образец медицинского изделия
- Удостоверение о госпошлине
- Данные о проведенных испытаниях и клинической экспертизе
Для оформления удостоверения о госпошлине компания должна предоставить себя и свои обязательства!
Далее, компания-заявитель должна провести испытания и клиническую экспертизу медицинского изделия. Для этого она может обратиться в ГОСТ-эксперт, ЦИРМИ (Центр испытания и сертификации медицинской продукции) или «ВНИИИМТ» (Всероссийский научно-исследовательский институт медицинской техники). Проведение испытаний поможет определить соответствие изделия требованиям безопасности и эффективности.
После этого компания подает заявление на госрегистрацию медицинского изделия в Росздравнадзор. В случае выполнения всех требований и успешного прохождения экспертизы, компания получает удостоверение о госрегистрации и может начать продажу своей медицинской продукции на рынке.
Опасность отсутствия регистрации медицинского изделия заключается в невозможности его ввоза и продажи на российском рынке. Риск задержек и штрафов также определяется без регистрации медицинского изделия.
Таким образом, регистрация медицинских изделий является обязательной процедурой, которую компания должна выполнить для использования и продажи своей продукции в России. Соблюдение всех требований и прохождение всех этапов регистрации гарантирует соответствие медицинского изделия стандартам и безопасности.
Сбор и подготовка необходимых документов
Первым этапом состоит во взятии образца или выборе идеи медицинского изделия, которому будет предоставляться госрегистрация. Затем компания должна предоставить сведения о своей организации и осуществить подписание договора с клиническим или государственным центром.
В процессе сотрудничества с клиническим центром осуществляется проведение необходимых испытаний медицинскому изделию: клинический и прочие. Для проведения клинических испытаний важно предоставить все необходимые документы, включающие заявление на проведение испытаний, паспортные данные сотрудников, участвующих в проведении испытаний, и другие документы.
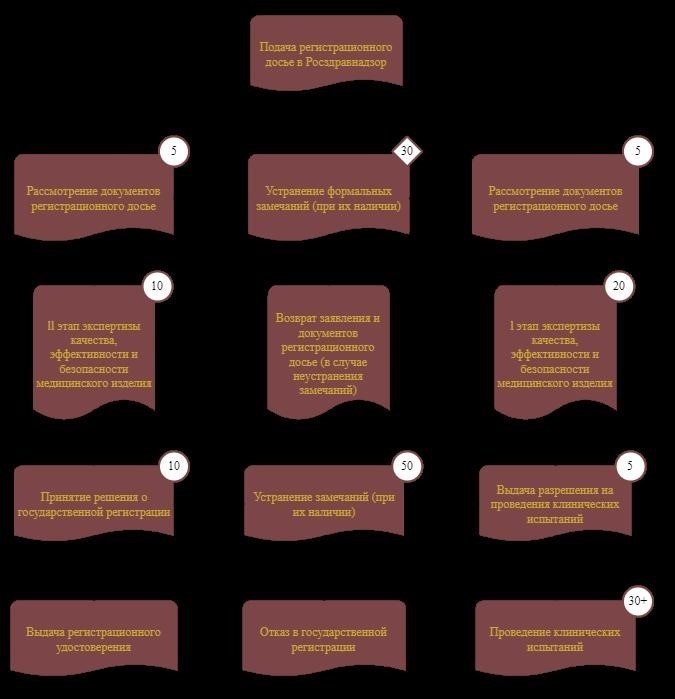
В процессе сотрудничества с государственным центром необходимо предоставить заявление о государственной регистрации медицинского изделия, образец медицинского изделия, обязательную документацию по медицинскому изделию, а также документацию, подтверждающую соответствие медицинского изделия требованиям безопасности и эффективности.
Этапы государственной регистрации медицинских изделий:
1. Подача заявки на государственную регистрацию.
2. Подготовка документации на медицинское изделие.
3. Испытания медицинского изделия: клинические, лабораторные и прочие.
4. Экспертиза документации в ГК «НИК».
5. Принятие решения о регистрации изделия.
6. Выдача сертификата на государственную регистрацию.
Относится ли регистрация медицинских изделий к обязательной процедуре?
Да, регистрация медицинских изделий является обязательной процедурой в России. Перед ввозом медицинских изделий на рынок России необходимо пройти государственную регистрацию и получить соответствующие документы – сертификаты на медицинские изделия.
Компания, зарегистрировавшая медицинские изделия, берет на себя ответственность за качество и безопасность своей продукции.
Почему стоит сотрудничать с госэкспертом при регистрации медицинских изделий?
Госэксперт является органом, определяющим соответствие медицинского изделия требованиям безопасности и эффективности. Сотрудничество с госэкспертом гарантирует точное соблюдение всех требований и профессиональное проведение регистрации медицинских изделий.
Наши сотрудники – высококвалифицированные профессионалы, имеющие многолетний опыт в области регистрации медицинских изделий. Мы ориентируемся на предоставление высококачественных услуг и гарантируем успешное прохождение всех этапов государственной регистрации.
При сотрудничестве с нами компания может быть уверена в своей полной подготовке к регистрации медицинских изделий и получении необходимых сертификатов.
Мы берем на себя все обязательства, связанные с организацией и проведением регистрации медицинских изделий, и предоставляем клиентам полную поддержку и консультацию на всех этапах регистрации.
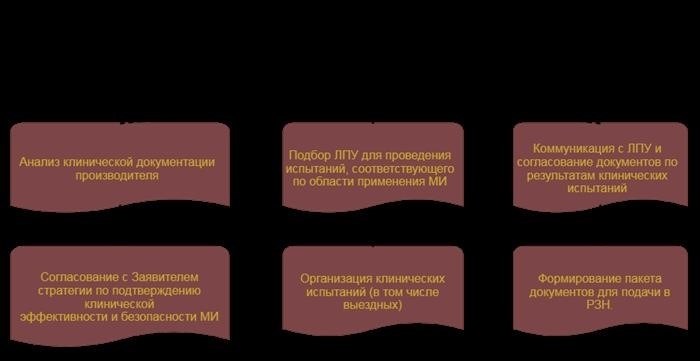
Проведение клинических испытаний
Государственная экспертиза клинических испытаний
Проведение клинических испытаний осуществляется с сотрудничества с государственными органами, такими как Росздравнадзор. Государственная экспертиза клинических испытаний позволяет проверить соответствие проводимых испытаний требованиям, установленным законодательством.
Программа клинических испытаний должна быть разработана в соответствии с принципами и методикой клинических испытаний, определенной законодательством. Что касается проведения клинических испытаний за границей, то в таком случае может потребоваться документ, подтверждающий согласие компетентного органа другого государства на их проведение.
Этапы проведения клинических испытаний
Процесс проведения клинических испытаний включает следующие этапы:
- Разработка протокола клинических испытаний;
- Набор и рандомизация пациентов;
- Проведение испытаний со сбором данных;
- Анализ результатов и оценка эффективности;
- Подготовка отчета о проведенных испытаниях.
В процессе клинических испытаний основная цель — доказать эффективность и безопасность медицинского изделия. При этом необходимо учитывать различные факторы, включая состояние здоровья пациентов, характеристики изделия и протокол испытаний.
Отсутствие обязательств!
Важно отметить, что проведение клинических испытаний не является гарантией получения регистрационного удостоверения для медицинского изделия. Решение о выдаче регистрационного удостоверения принимается государственным органом на основе анализа результатов клинических испытаний и предоставленных документов.
Росздравнадзор оставляет за собой право отклонить заявление на регистрацию изделия, если оно не соответствует требованиям законодательства или необходимы дополнительные испытания и исследования.
Мы, в «НИК», работаем с 2020 года и предоставляем клиентам все необходимые услуги по проведению клинических испытаний и регистрации медицинских изделий. Мы ориентируемся на национальные и международные требования и руководствуемся принципами этического и ответственного подхода к нашей работе.
У нас работают профессиональные сотрудники с большим опытом в области клинических испытаний и регистрации медицинских изделий. Мы гарантируем высокое качество нашей работы и предоставляем все необходимые услуги на каждом этапе процесса регистрации изделия:
- Подача заявления на регистрацию;
- Оплата государственной пошлины;
- Получение регистрационного удостоверения.
Мы предлагаем различные виды услуг, связанных с регистрацией медицинских изделий, в том числе разработку необходимых документов и проведение клинических испытаний. Мы готовы работать в тесном сотрудничестве с клиентами и выполнять все обязательства!
Подача заявления на регистрацию
Первым этапом подачи заявления на регистрацию медицинского изделия является осуществление предложения об услуге от компании, которая занимается регистрацией. В этом предложении должны быть указаны все необходимые данные об изделии, включая его название, образец, описание и назначение.
После согласования предложения и взятия на себя обязательств компания преступает к следующему этапу – оформлению заявления на регистрацию. В данном заявлении должны быть указаны все необходимые данные о компании, включая полное наименование, адрес и контактные данные.
Важно отметить, что подача заявления осуществляется на свободной основе, без каких-либо обязательств со стороны компании. Однако, помимо подачи заявления, необходимо предоставить все подтверждающие документы, включая результаты испытаний и сертификаты качества.
За прохождение всех этапов регистрации компания должна нести коммерческое и юридическое риски. В случае успешного завершения процедуры регистрации медицинского изделия, его можно будет ввозить и продавать на территории России в соответствии с законами и правилами.
Регистрацию медицинского изделия можно проводить поэтапно, начиная с предоставления заявления на регистрацию. Затем следует проведение испытаний и удовлетворение требований по СМК (система менеджмента качества) или отдельно по ГОСТам. После этого происходит составление регистрационного досье и его сдача в соответствующие органы для проведения экспертизы и рассмотрения заявления.
Однако, необходимо учесть, что процедура регистрации может сопровождаться задержками в выдаче регистрационного удостоверения, так как проведение испытаний и экспертизы требует времени.
Важно подчеркнуть, что регистрация медицинских изделий – это сложный процесс, который требует сотрудничества компании с экспертами и соблюдения всех правил и требований. Компания должна предоставить полную информацию о изделии и пройти все этапы регистрации, чтобы получить регистрационное удостоверение, подтверждающее его соответствие всем необходимым стандартам и требованиям.
Компания, желающая зарегистрировать медицинское изделие, может обратиться к нам. Мы готовы предоставить все необходимые услуги по регистрации, включая оформление заявления, проведение испытаний и подготовку регистрационного досье. Наши высококвалифицированные сотрудники гарантируют эффективное и успешное прохождение процедуры регистрации вашего медицинского изделия в соответствии с правилами и законами года.